
人类生活在复杂多变的环境中,每时每刻都会接触到各种各样的微生物,受到一些类似抗原物质的侵扰,从而使机体致病。为了抵御这些外来侵扰,使自身得以继续生存,人体必须形成几十万、几百万甚至更多种相应的特异性抗体以抵抗外界的抗原物质,才能免遭其害,保护自己。我们会从抗体的产生及多样性进行其原因的阐述与分析。
1.抗原的呈递
抗原呈递细胞(antigen presenting cell, APC)的抗原呈递作用是一个涉及抗原摄取、处理与呈递的复杂过程[1]。最主要的抗原呈递分子是主要组织相容性复合物(majorhistocompatibility complex, MHC)[2]。MHC分为两个大类:MHC-I和MHC-II,它们呈递的抗原蛋白来源不同,降解抗原的方式不同,结合肽段长度也不同,可以分别将抗原呈递给细胞毒性T细胞 (CD8 T cell) 和辅助型T细胞 (CD4 T cell)[3,4] 。
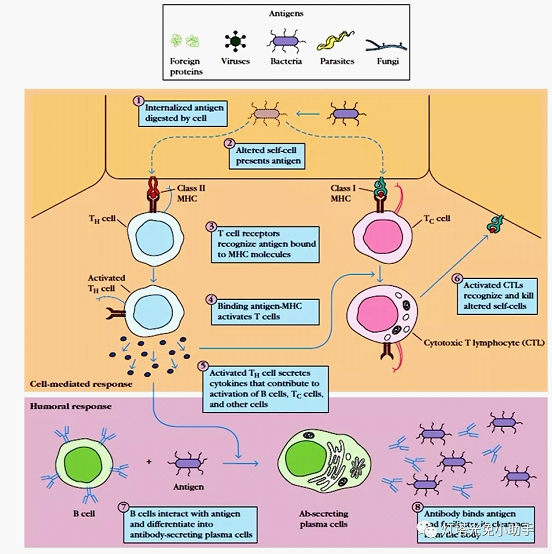
现以MHC-II呈递外源性蛋白为例简述抗原提成过程。
外源性抗原经APC吞噬或吞饮作用,被摄入胞内形成吞噬体,后者与溶酶体融合形成吞噬溶酶体。抗原在吞噬溶酶体内酸性环境中被蛋白水解酶降解为小分子多肽,其中具有免疫原性的称为抗原肽[3,5]。内质网中合成的MHC-II类分子进入高尔基体后,由分泌小泡携带,通过与吞噬溶酶体融合,使抗原肽与小泡内MHC-Ⅱ类分子结合形成抗原肽-MHCⅡ类分子复合物。所形成的复合物可能在高尔基复合体参与下被转运到细胞膜表面,被T细胞受体(TCR)识别并呈递给TH细胞[6]。供TCR识别的先决条件是两种细胞的直接接触并相互作用。这种细胞间的相互作用涉及APC与TH表面多种分子。除了TCR特异性地同时识别多肽-MHC-Ⅱ分子的复合物外,某些粘附分子也参与抗原呈递过程。活化的TH细胞可分泌各种细胞因子,用于B细胞、Tc细胞等的激活过程,产生可清除抗原的特异性抗体。
2.B细胞分化及抗体的产生
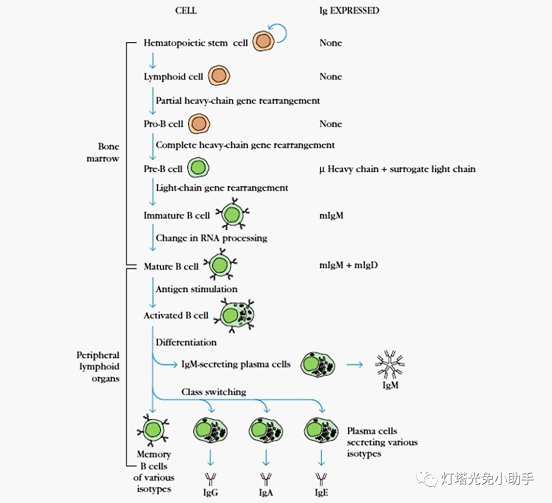
哺乳类动物B细胞的分化过程主要可分为前B细胞、不成熟B细胞、成熟B细胞、活化B细胞和浆细胞五个阶段。其中前B细胞和不成熟B细胞的分化是抗原非依赖的,其分化过程在骨髓中进行,不成熟B细胞开始表达膜结合型IgM(mIgM)。抗原依赖阶段是指成熟B细胞(膜表面同时表达mIgM和mIgD)在抗原刺激后,在APC和TH细胞的辅助下成为活化B细胞(mIg水平逐渐降低,分泌型Ig逐渐增加,并可发生Ig基因重链的类别转换),并继续分化为合成和分泌抗体的浆细胞,发挥体液免疫的功能,这个阶段的分化主要是在外周免疫器官中进行的。
因此,抗体存在于脊椎动物的血液等体液中,及其B细胞的细胞膜表面,其主要功能是与抗原结合后,有效地清除侵入机体内的微生物、寄生虫等异物。
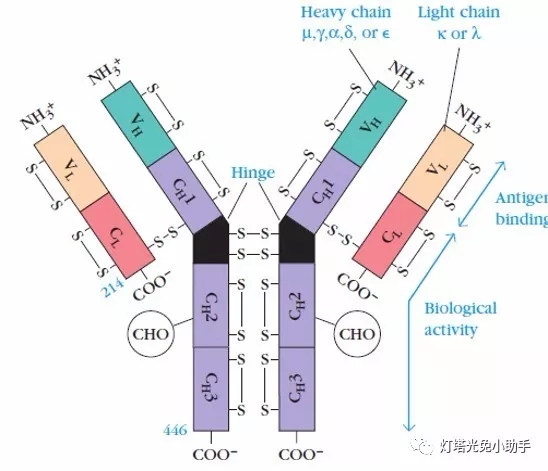
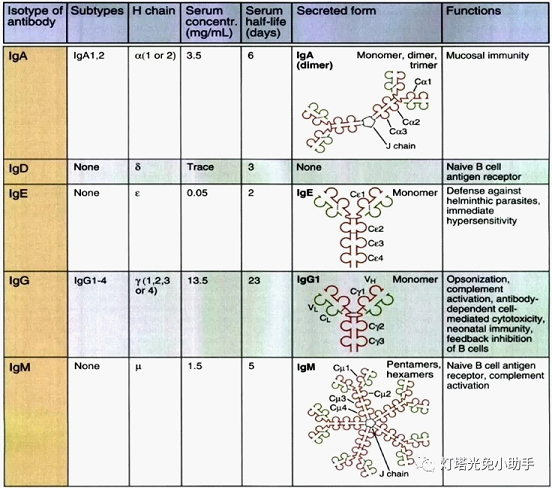
抗体是具有4条多肽链的对称结构,其中2条较长、相对分子量较大的相同的重链(H链);2条较短、相对分子量较小的相同的轻链(L链)。链间由二硫键和非共价键联结形成一个由4条多肽链构成的单体分子。轻链有κ和λ两种,重链有γ、μ、α、ε和δ五种[7],依据重链分型不同Ig分为IgM、IgG、IgA、IgD和IgE 五类。
整个抗体分子可分为恒定区和可变区两部分。在给定的物种中,不同抗体分子的恒定区都具有相同的或几乎相同的氨基酸序列。可变区位于"Y"的两臂末端,也称抗原结合片段(antigen-binding fragment, Fab),一个抗体分子上的两个抗原结合部位是相同的;"Y"的柄部称结晶片段(crystalline fragment, FC)。
3.免疫球蛋白多样性
抗体的组成极为复杂,是由成千上万、多种多样的Ig分子所组成。这些Ig分子在形状、大小、结构以及氨基酸的组成和排列上,既相似,又有差别。
3.1可变区异质性
恒定区的基因可以决定Ig分子的类别和亚类,为造成Ig分子多样性的原因之一,但造成免疫球蛋白分子多样性的主要原因在于可变区的异质性。
在可变区内有一小部分氨基酸残基变化特别强烈,这些氨基酸的残基组成和排列顺序更易发生变异,称高变区。高变区位于分子表面,最多由17个氨基酸残基构成,少则只有2~3个。高变区是抗原结合位,与抗原表位互补,又称为互补决定区(complement-determiningregions,CDRs)[8],其氨基酸序列决定了该抗体结合抗原抗原的特异性[9,10]。重链及轻链各含有三个CDR,在三维空间结构中呈现为环状,分布在抗体分子表面与抗原特异性结合。
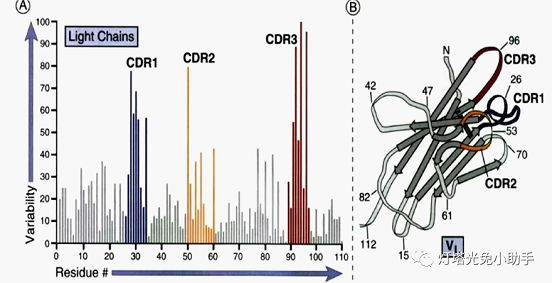
3.2 V(D)J重组
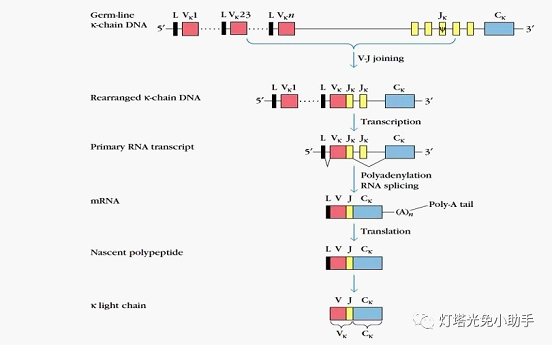
抗体的L链由C、V、J三个基因簇编码
H链由C、V、D、J四个基因簇编码
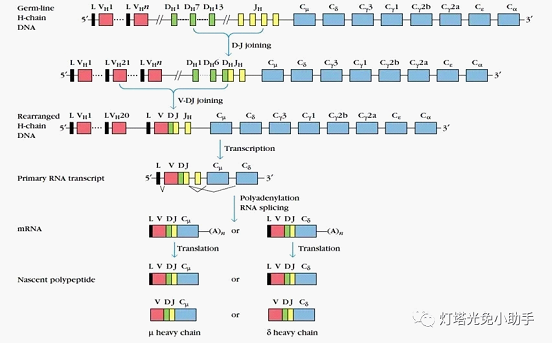
人类控制免疫球蛋白H链的基因位点在第14号染色体长臂上,由编码可变区的V基因片段(VH)、D基因片段(DH)、J基因片段(JH)、C基因片段(CH)4类基因片段组成,其中VH有45种、DH有23种、JH有6种、CH有9种[18]。H链上的恒定区由C基因片段控制,一般是恒定不变的;H链上的可变区由VH、DH、JH 3种基因片段控制。在浆细胞成熟过程中重链基因的VH、JH、DH 3种基因片段间可以发生随机重组,不同的组合导致产生不同结构的重链基因。
根据体细胞基因重排学说,B细胞在完成重链可变区基因的重排后,开始轻链(Lλ链和Lκ链)可变区基因的重排。人类控制Lλ链的基因位点在第22号染色体长臂上,有Vλ、Jλ和Cλ 3类基因片段,其中Vλ有30种、Jλ有4种、Cλ有4种。Lλ链上的恒定区由Cλ基因片段控制,一般是恒定不变;Lλ链上的可变区由Vλ和Jλ2种基因片段控制。在浆细胞成熟过程中,Lλ链基因的Vλ和Jλ 2种基因片段间可以发生随机重组,不同的组合产生不同结构的Lλ链基因。人类控制Lκ链的基因位点在第2号染色体短臂上,有Vκ、Jκ、Cκ 3类基因片段,其中Vκ有40种、Jκ有5种、Cκ仅1种[18]。
这些外显子在重组酶(RE)的作用下,通过多种多样的重排,所合成出的肽链,还要再进一步进行L和H链组合,这样最后生成的抗体种类就非常多了[12]。抗体基因重排发生在淋巴细胞分化的时候[13]。
3.3类别转换
一个B淋巴细胞克隆在分化过程的初期,不成熟B细胞只表达mIgM和mIgD,这两种Ig具有相同的抗原结合区域。抗原激活B细胞后,膜上表达和分泌的Ig类别会从IgM转换成IgG、IgA、IgE等其他类别或亚类的Ig[12]。此时VH基因片段保持不变,而发生CH基因节段的重排,即结合抗原的特异性相同,但其重链类型(恒定区)发生改变。这样,同一B细胞的子代细胞就可以产生针对同一抗原的、特异性的、不同类别的抗体。局部微环境和细胞因子可影响和调节免疫球蛋白的类型转换[14]。
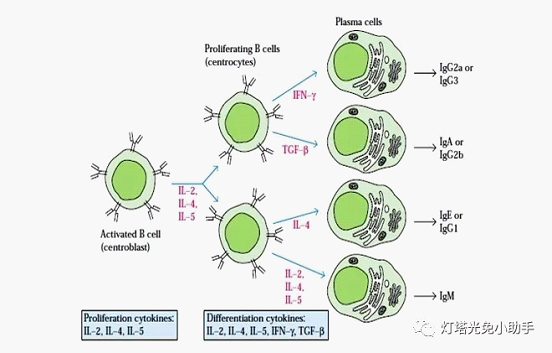
细胞因子调节B细胞Ig类别转换的机理可能是:(1)刺激某些细胞的克隆选择性的增殖,使分泌某特定类、亚类抗体的克隆细胞增加,如IL-5、IL-6促进IgA产生除通过同种型转换进行调节外,还可选择性促进IgA定向细胞分化增殖为IgA分泌细胞。(2)通过诱导特定位置上两个转换区的重组,诱导B细胞由分泌IgM向某一同种型Ig转换。
3.4体细胞高频突变和抗体的亲和力成熟
B细胞在完成重链基因、轻链基因的重排后,成熟的B细胞在外周淋巴器官生发中心接受抗原刺激后会发生高频度的突变,主要在重链区基因发生碱基点突变,称为体细胞高频突变(somatic hypermutation)[15]。体细胞的高频突变极大增加了免疫球蛋白基因的多样性,同时还可以使形成的抗体亲和力进一步成熟。
突变后产生的各种B细胞克隆的BCR亲和力各不相同,在其表面表达高亲和力抗体的B细胞会在与其他细胞的反应中获得强烈的存活信号,而表达低亲和力抗体的B细胞则逐渐凋亡[16]。其总体结果是,后代B细胞及其产生的抗体对抗原的平均亲和力得到了提升,称为抗体的亲和力成熟(affinity maturation),使所分泌的抗体可更有效地保护机体免受外来抗原的再次侵袭[17]。只有那些表达高亲和力抗原受体的B细胞,才能有效的结合抗原,并在抗原特异的Th细胞增殖,产生高亲和力抗体[17]。
在以上多样性抗体基因指导下,形成了多种多样的重链蛋白质分子和轻链蛋白质分子。此外,受体编辑、免疫球蛋白的类别转换等因素也可以大大增加免疫球蛋白结构的多样性[18]。可以说,自然界有多少种抗原物质,人体就能产生多少种免疫球蛋白分子,就能形成多少种抗体。
参考文献
1. Mann, Elizabeth R. "Intestinalantigen-presenting cells in mucosal immune homeostasis: Crosstalk betweendendritic cells, macrophages and B-cells". World Journal ofGastroenterology. 20 (29): 9653.
2. Kambayashi, Taku;Laufer, Terri M. "Atypical MHC class II-expressing antigen-presentingcells: can anything replace a dendritic cell?". Nature Reviews Immunology.14 (11): 719–730.
3. Den Haan, Joke M.M.;Arens, Ramon; Zelm, Menno C. van. (2014). "The activation of the adaptiveimmune system: Cross-talk between antigen-presenting cells, T cells and Bcells". Immunology Letters. 162 (2): 103–112.
4. Hivroz, Claire;Chemin, Karine; Tourret, Marie; Bohineust, Armelle. "Crosstalk between TLymphocytes and Dendritic Cells". Critical Reviews™ in Immunology. 32 (2): 139–155.
5. Dalod, M.; Chelbi, R.;Malissen, B.; Lawrence, T. (2014). "Dendritic cell maturation: functionalspecialization through signaling specificity and transcriptionalprogramming". The EMBO Journal. 33 (10): 1104–1116.
6. Sadegh-Nasseri,Scheherazade; Chou, Chih-Ling; Hartman, Isamu Z.; Kim, AeRyon; Narayan, Kedar(2012). "How HLA-DM works: recognition of MHC II conformationalheterogeneity". Frontiers in Bioscience. 4: 1325–1332.
7. Charles Janeway(2001). Immunobiology (5th ed.). Garland Publishing.
8. Al-Lazikani B, LeskAM, Chothia C (1997). "Standard conformations for the canonical structuresof immunoglobulins". J Mol Biol. 273 (4): 927–948.
9. Woof J, Burton D(2004). "Human antibody-Fc receptor interactions illuminated by crystalstructures". Nat Rev Immunol. 4 (2): 89–99.
10. Heyman B (1996)."Complement and Fc-receptors in regulation of the antibody response".Immunol Lett. 54 (2–3): 195–199.
11. Nemazee D (2006)."Receptor editing in lymphocyte development and central tolerance".Nat Rev Immunol. 6 (10): 728–740.
12. Market E, PapavasiliouFN (2003). "V(D)J recombination and the evolution of the adaptive immunesystem". PLoS Biol. 1 (1): E16.
13. Market, Eleonora;Papavasiliou, F. Nina (2003). "V(D)J Recombination and the Evolution ofthe Adaptive Immune System". PLoS Biology. 1 (1): E16.
14. Stavnezer J, AmemiyaCT (2004). "Evolution of isotype switching". Semin. Immunol. 16 (4):257–275.
15. Diaz M, Casali P(2002). "Somatic immunoglobulin hypermutation". Curr Opin Immunol. 14(2): 235–240.
16 Or-Guil M, WittenbrinkN, Weiser AA, Schuchhardt J (2007). "Recirculation of germinal center Bcells: a multilevel selection strategy for antibody maturation". Immunol.Rev. 216: 130–41.
17. Neuberger M,Ehrenstein M, Rada C, Sale J, Batista F, Williams G, Milstein C (2000)."Memory in the B-cell compartment: antibody affinity maturation".Philos Trans R Soc Lond B Biol Sci. 355 (1395): 357–360.
18. 曹雪涛,熊思东,姚智.医学免疫学.北京:人民医学出版社,2013:77.