
习近平主持深改组会议审议通过了《关于改革完善仿制药供应保障及使用政策的若干意见》
专栏:法规动态
发布日期:2018-01-25
阅读量:5978
新华社北京1月23日电 中共中央总书记、国家主席、中央军委主席、中央全面深化改革领导小组组长习近平1月23日下午主持召开中央全面深化改革领导小组第二次会议并发表重要讲话。他强调,2018年是贯彻党的十九大精神的开局之年,也是改革开放40周年,做好改革工作意义重大。要弘扬改革创新精神,推动思想再解放改革再深入工作再抓实,凝聚起全面深化改革的强大力量,在新起点上实现新突破。
会议指出,改革完善仿制药供应保障及使用政策,要从群众需求出发,把临床必需、疗效确切、供应短缺、防治重大传染病和罕见病、处置突发公共卫生事件、儿童用药等作为重点,促进仿制药研发创新,提升质量疗效,提高药品供应保障能力,更好保障广大人民群众用药需求。
CDE 认定符合条件的药物进行梳理:
1.临床必需、供应短缺药物(7 个)
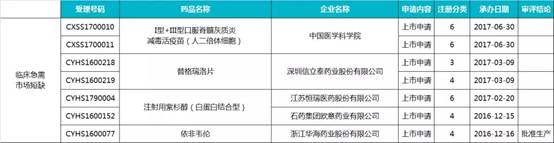
2. 防治重大传染病药物(2 个)

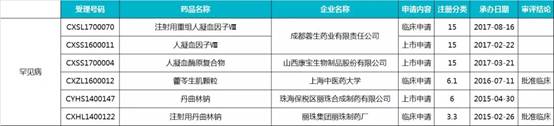
3.防治罕见病药物(6 个)
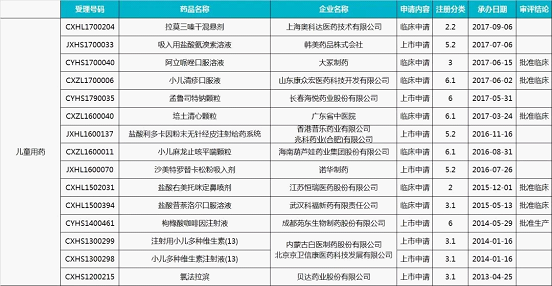
4.儿童用药药物(15 个)
对于还未批准上市的临床急需品种,会有相应的政策加快审批。
CFDA 后续会持续优化对于这部分临床急需药品的审评审批程序,在满足一定条件的基础上加速上市,从而降低企业研发成本。
对于已经批准上市的临床急需药物,会有相应的政策给与优待。
会通过进入医保目录、招标中标、患者的报销比例等等措施,最大程度提升企业药品上市后的回报。
一些列政策的推出映证着 CFDA 对优先审评工作的重视程度。CFDA 在努力做好自身工作,加快向市场输送临床急需仿制药的速度。
同时,也在用政策利好来吸引企业关注,呼吁更多的企业加入研发临床急需药物的行列。最终的目的总是一致的,让老百姓能真正“用得上药”“用得起药”。